pH¶

¿Qué es el pH?¶
Definición
El pH es una medida de acidez o alcalinidad de una disolución acuosa. La definición formal es que el pH es un indicador de la concentración de iones de hidrógeno presentes en soluciones acuosas. La concentración de iones de hidrógeno se calcula como:
Lo que esto quiere decir, es que a un pH más alto, hay menos iones de hidrógeno libres y que un cambio de una unidad de pH refleja un cambio de diez veces en la concentración del ion de hidrógeno. Por ejemplo, hay 10 veces más iones de hidrógeno disponibles a un pH de 7 que a un pH de 8. La escala de pH va de 0 a 14, y un pH de 7 se considera neutro. Las sustancias con pH inferior a 7 son ácidas; mientras que las sustancias con pH superior a 7 son básicas o alcalinas. Es un indicador de aguas que cambian químicamente.
Extra ball
Un concepto interesante relacionado con el pH es el de alcalinidad, que es la resistencia a cambios en el pH de una solución.
¿Por qué es importante?¶
El pH determina la solubilidad y la disponibilidad biológica de sustancias químicas como nutrientes (fósforo, nitrógeno y carbono) y de metales pesados (plomo, cobre, cadmio, etc.). En otras palabras, indica qué cantidad de sustancias se puede disolver en el agua y qué cantidad puede ser utilizada por la seres vivos acuáticos que la habitan. Por ejemplo, además de afectar cuánto y qué tipo de fósforo es más abundante en el agua, el pH también determina si la vida acuática puede disponer de él. En el caso de los metales pesados, el grado de solubilidad determina su toxicidad. Los metales tienden a ser más tóxicos a un pH más bajo porque son más solubles.
En el caso de los nutrientes, un cambio en el pH puede aumentar la solubilidad del fósforo, haciéndolo más disponible para el crecimiento de las plantas y resultando en una mayor demanda a largo plazo de oxígeno disuelto. Normalmente, las condiciones de contaminación del agua suelen corresponder a un aumento de la fotosíntesis de las plantas, y hace que la contaminación pueda provocar un aumento del pH a largo plazo. La preocupación más común son los cambios en el pH causados por la descarga de efluentes municipales o industriales. Sin embargo, el pH de la mayoría de los efluentes es bastante fácil de controlar y, a menudo, se regula.
En el mar
El pH del agua de mar está normalmente en valores neutro-básicos moderados entre 7.4 y 8.5.
El grado de pH presenta un rol importante en los ciclos de carbono oceánico. Hay evidencia de que la acidificación de los océanos se ha visto provocada por emisiones de CO2. El océano absorbe aproximadamente el 30% de las emisiones de CO2 de la atmósfera y, cuando esto pasa, se produce una reacción química que genera iones de hidrógeno en el agua. Una mayor concentración de iones de hidrógeno implica un pH más ácido. Como decíamos arriba, el pH determina la solubilidad y la disponibilidad de nutrientes para la vida acuática (Nitrógeno, fósforo, etc.). Es decir, no sólo indica si los seres vivos acuáticos tienen nutrientes a su disposición, sino si lo pueden absorber. Un pH ácido podría además limitar el crecimiento de corales, y otras especies que viven fijas, como las ostras o los mejillones, que en aguas ácidas tendrían más dificultad para generar sus cáscaras.
El océano y la fotosíntesis de sus organismos vegetales (fitoplancton en particular) absorben CO2 y producen oxígeno (O2). El océano absorbe así el 30% del CO2 del planeta y produce entre el 50% y el 75% del oxígeno que respiramos, dependiendo de las fuentes y zonas geográficas. El calentamiento del océano así como su acidificación ponen en peligro la supervivencia del fitoplancton, las praderas de fanerógamas marinas, los manglares y las marismas que son auténticas trampas de CO2. Sin embargo, el 20% de los manglares del planeta ya desaparecieron entre 1980 y 2005. Siempre más ácido, el océano también ve aparecer zonas desoxigenadas fatales para la vida marina y para los equilibrios globales.
Impacto de la acidez
La acidez del océano ha sido la misma durante cien millones de años con un pH de 8,18 c. Al absorber el CO2 que producimos, ahora está en 8,08 y la tendencia se acelera. Concretamente, esto significa que el océano ya es un 30% más ácido y será un 50% más ácido en 2100. Con consecuencias directas sobre los animales marinos.
-
Más CO2: La acidificación de los océanos dificulta que los pequeños organismos marinos atrapen CO2 al construir sus caparazones.
-
Menos coral: La acidificación de los océanos provoca el blanqueamiento y la desaparición de los corales, que albergan el 25 % de las especies de peces y sustentan a más de mil millones de personas.
-
Menos comida: La acidificación de los océanos es corrosiva para las conchas de los pequeños caracoles marinos, que son el primer nivel de la cadena alimentaria.
Curiosidades
Las aguas con pH alto (alcalino, básico) tienen un gusto amargo, y provocan depósitos en tuberías. Además, puede cancelar el efecto del cloro a nivel desinfectante.
Por el contrario, aguas con un pH bajo (ácido) tienden a provocar una mayor corrosión y disolución de metales y otras substancias.
¿Cómo medir pH?¶
Los valores de pH pueden variar muy rápidamente. Este parámetro se debe medir en campo inmediatamente después de recoger la muestra. Se puede medir a posteriori en laboratorio, pero no será completamente representativo. Para medirlo, por tanto, usaremos un sensor de pH.
El sensor¶
Usaremos un sensor de pH, compuesto por una membrana de cristal (muy delicada) a través de la cual algunos iones de Hidrógeno del agua pueden pasar y generar una corriente muy pequeña que mediremos en un electrodo.

FUENTE: Atlas Scientific
El sensor se puede sumergir completamente, y tiene las siguientes características (aquí citamos algunas, tienes todas en el datasheet):
- Rango en pH: 1 a 13
- Máxima profundidad en agua: 35m
- Velocidad de respuesta: 95% en 4s
- Seguro para usar en alimentos/bebidas
Antes de hacer nada, revisa este datasheet (hoja de datos):
Si tu sensor es transparente (no amarillo): https://files.atlas-scientific.com/consumer-grade-pH-probe.pdf
Si tu sensor es transparente y amarillo: https://files.atlas-scientific.com/lab-grade-pH-probe.pdf
Si tu sensor es negro: https://files.atlas-scientific.com/lab-grade-pH-probe.pdf
Cómo preparar el sensor¶
Calibración
Si el sensor no está calibrado, sigue el procedimiento descrito en esta guía
Para sacar el sensor del bote de protección:
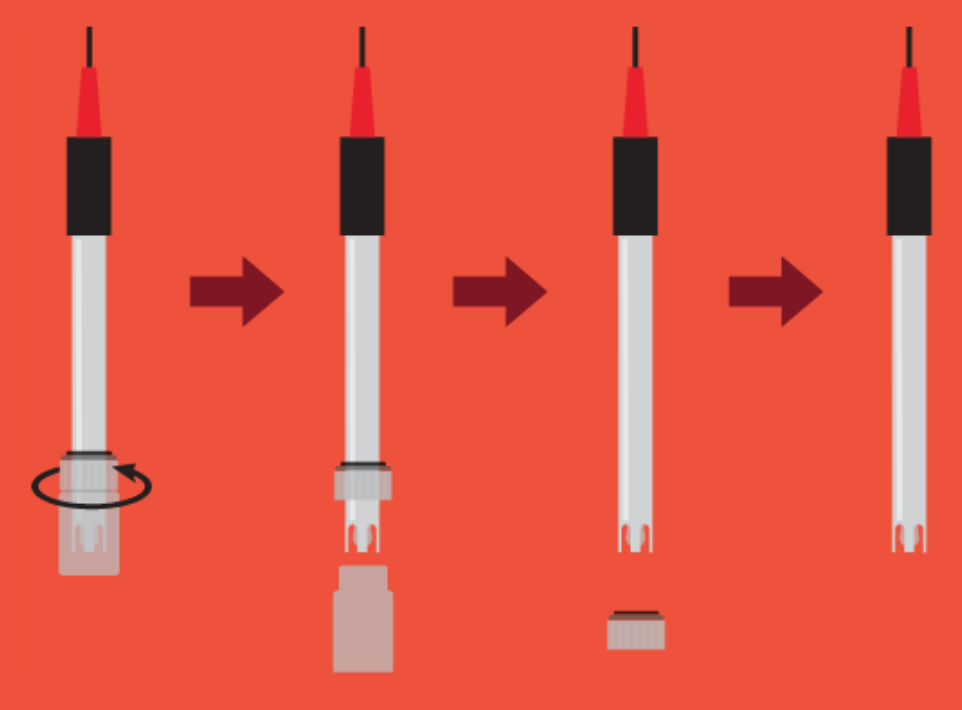 FUENTE: Atlas Scientific
FUENTE: Atlas Scientific
El sensor de pH se debe mantener húmedo durante la preparación de la muestra. Es posible que veas formación de Cloruro de Potasio (KCl) en la sonda. Límpialo con agua destilada, con cariño, y úsalo normalmente.
 FUENTE: ThermoScientific - KCl Creep
FUENTE: ThermoScientific - KCl Creep
¡Trátalo con cuidado!
El sensor de pH es muy delicado, y tiene una esfera de cristal en la punta. Úsalo con cuidado, y sobre todo no lo golpees. No es buena idea sumergirlo en tierra o sustancias que sean difíciles de limpiar.

Cómo medir¶
- Calibra la sonda previamente, como se indica en el apartado anterior (en caso de que no lo hayas hecho ya, o no lo haya hecho nadie por ti)
- La muestra se puede tomar en un recipiente de cristal o de plástico. Simplemente, toma suficiente cantidad para que puedas sumergir la sonda. Limpia la sonda con el mismo agua que quieres medir (pero no el de la muestra) antes de introducir la sonda en el recipiente
- Introduce la sonda en la muestra y toma varias lecturas (en general 3 lecturas son suficientes). Cuando la sonda esté sumergida en la muestra, muévela suavemente para que no queden burbujas de aire que puedan afectar a la medida. Si tarda mucho tiempo en estabilizarse, muévela suavemente, ¡pero no la agites, porque podrías provocar cambios en la lectura!
- Cuando las lecturas sean estables, toma ese valor como válido y anótalo.
- Repite la lectura 2 veces más.
Recursos adicionales
Sobre la acidificación de los océanos y su impacto: https://www.noaa.gov/education/resource-collections/ocean-coasts/ocean-acidification